
Sistema de Notificación y Aprendizaje de Errores de Medicación
Etiquetado/envasado proclive a error
 Errores de sobredosificación asociados al etiquetado de Depakine ® 400 mg vial (valproato sódico)
Errores de sobredosificación asociados al etiquetado de Depakine ® 400 mg vial (valproato sódico)
- 24/03/2024
Este etiquetado puede llevar fácilmente a que se interprete equivocadamente que la concentración (100 mg/mL) se corresponda con el contenido total de los viales (400 mg), y como consecuencia se administre una dosis 4 veces mayor a la prescrita.
Esta fue la causa de un error que describe cómo, ante una prescripción de una dosis de 400 mg de Depakine®, se administraron 4 viales (1600 mg) en la unidad de hospitalización.
Para evitar estos errores se recomienda adquirir este medicamento a otro proveedor que tenga un etiquetado más seguro o bien reetiquetar los viales de Depakine® indicando la cantidad total que contienen de forma más visible.

Depakine® 400 mg vial |
 Se recuerda el riesgo de confusión entre las ampollas de 10 mL de Mepivacaína 2% y Midazolam 50 mg Normon
Se recuerda el riesgo de confusión entre las ampollas de 10 mL de Mepivacaína 2% y Midazolam 50 mg Normon
- 24/02/2024
Como se indicó en esta sección en 2016 y 2019, las ampollas de 10 mL de Mepivacaína 2% y de Midazolam 50 mg de Normon presentan una apariencia similar, ya que tienen el mismo tamaño y un serigrafiado muy similar, con el etiquetado dispuesto en la parte superior de la ampolla y unas anillas de color verde y amarillo.
Se han notificado algunos incidentes que describen errores en el almacenamiento o en la dispensación, que podrían haber dado lugar a errores en la administración.
Para evitar posibles errores se recomienda adquirir estos medicamentos a diferentes proveedores, buscando siempre que su apariencia sea distinta.

Mepivacaína 2% 10 mL y Midazolam Normon 50 mg/10 mL |
 Confusión entre los viales de Gemcitabina Accord® 2 g/20 mL y Citarabina Accord® 2 g/20 mL
Confusión entre los viales de Gemcitabina Accord® 2 g/20 mL y Citarabina Accord® 2 g/20 mL
- 31/10/2023
El etiquetado de los envases y viales de Gemcitabina Accord® 2 g/20 mL y Citarabina Accord® 2 g/20 mL se parece, ya que predomina el color del fondo y la imagen de marca. Aunque el recuadro con el nombre del medicamento y la dosis es de distinto color, no resulta suficiente.
Se han recibido algunas notificaciones que describen como se cogió equivocadamente un medicamento por otro (Citarabina en lugar de Gemcitabina) cuando se iban a utilizar en una preparación. Afortunadamente los errores se detectaron en el momento de cargar el vial o en los controles posteriores a la preparación, por lo que no llegaron a los pacientes.
Para reducir el riesgo de confusión, se recomienda adquirir estos medicamentos a diferentes proveedores.

Gemcitabina Accord® 2 g/20 mL vial y Citarabina Accord® 2 g/ 20 mL vial |
 Siguen ocurriendo errores por administrarse equivocadamente por vía intravenosa las ampollas orales de Hidroferol® (calcifediol) 0,266 mg
Siguen ocurriendo errores por administrarse equivocadamente por vía intravenosa las ampollas orales de Hidroferol® (calcifediol) 0,266 mg
- 28/10/2023
Como se indicó en esta sección en 2017 y 2019, el Hidroferol® (calcifediol) es un medicamento destinado a la administración por vía oral, pero viene acondicionado en las ampollas de cristal ámbar utilizadas para acondicionar los medicamentos inyectables.
Este diseño del envase, no adecuado para un medicamento que se administra por vía oral, unido a un etiquetado poco legible (serigrafía en blanco y letras de pequeño tamaño) puede dar lugar a que se administre inadvertidamente por vía intravenosa. También puede confundirse fácilmente con medicamentos inyectables que presentan una apariencia similar.
El ISMP-España comunicó en varias ocasiones a la AEMPS la necesidad de modificar el acondicionamiento del Hidroferol®, de forma que su presentación sea adecuada a la vía oral y se evite el riesgo de administración por vía equivocada. Sin embargo, este cambio no se ha realizado, y se ha recibido la notificación de un nuevo incidente al respecto.
Por ello, se recuerda que es conveniente dispensar las ampollas reetiquetadas, indicando que son para administración por vía oral, y advertir de este problema a los profesionales sanitarios implicados en su uso, incorporando un mensaje en el programa de prescripción electrónica asociado a la administración de Hidroferol® (calcifediol) solución oral.
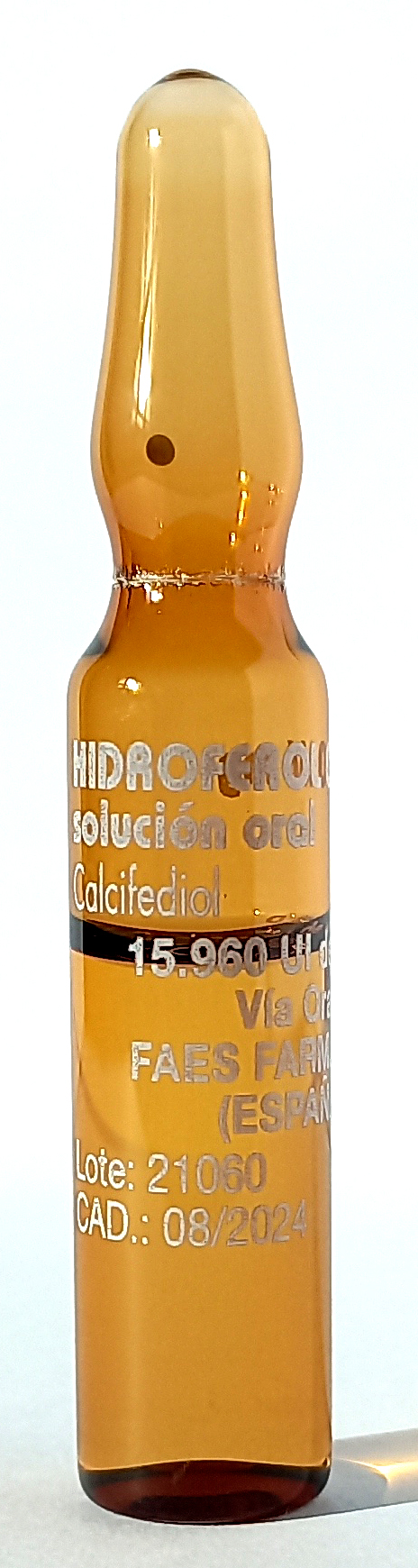
Hidroferol® 0,266 mg/1,5 mL solución oral |
 Riesgo de conservación incorrecta de los viales de Fetcroja 1 g (cefiderocol)
Riesgo de conservación incorrecta de los viales de Fetcroja 1 g (cefiderocol)
- 24/09/2023

Fetcroja® 1 g (cefiderocol) envase |
Fetcroja® 1 g (cefiderocol) viales |
 Confusión entre las bolsas de Ciprofloxacino Normon® 2 mg/mL 100 mL y Levobupivacaína Normon® 1,25 mg/mL 100 mL
Confusión entre las bolsas de Ciprofloxacino Normon® 2 mg/mL 100 mL y Levobupivacaína Normon® 1,25 mg/mL 100 mL
- 23/08/2023

Ciprofloxacino Normon® 2mg/mL |

Levobupivacaína Normon® 1,25mg/mL |
 Errores de dosificación asociados al etiquetado de Heparina sódica Rovi ® solución inyectable
Errores de dosificación asociados al etiquetado de Heparina sódica Rovi ® solución inyectable
- 04/08/2023
La expresión de la dosis de heparina en el etiquetado de la Heparina sódica Rovi 1.000 UI/mL y 5.000 UI/mL viales de 5 mL es proclive a error, ya que el contenido en heparina sólo se indica en el etiquetado de los viales mediante la concentración por mililitro.
Se puede interpretar equivocadamente que la concentración se corresponde con el contenido total de los viales, que tienen 5 mL, y como resultado administrar una dosis 5 veces mayor a la deseada, como ha ocurrido en alguna ocasión.
El ISMP-España ha comunicado a la AEMPS la necesidad de que en el etiquetado de estos viales se indique de forma destacada la cantidad total y el volumen total de heparina, en lugar de utilizar sólo la concentración, y la AEMPS está gestionando con el laboratorio titular la incorporación de este cambio.
Hasta que se realice esta modificación en el etiquetado, se recomienda reetiquetar los viales en aquellos centros en los que se utilice esta heparina.

Heparina sódica Rovi® 1.000 UI/mL y 5.000 UI/mL viales 5 mL |
 Riesgo de errores de dosificación asociados al cambio del etiquetado de Genta-Gobens® 40, 80 y 240 mg (gentamicina)
Riesgo de errores de dosificación asociados al cambio del etiquetado de Genta-Gobens® 40, 80 y 240 mg (gentamicina)
- 23/05/2023
La expresión de la dosis en el etiquetado de Genta-Gobens® de 80 mg ya era proclive a errores, al indicar la dosis como 40X2, pero recientemente ha cambiado, de manera que en el momento actual todas las presentaciones (40 mg, 80 mg y 240 mg) presentan un riesgo elevado de errores de dosificación.
En el nuevo etiquetado, el contenido en gentamicina se expresa sólamente mediante su concentración en miligramos por mililitro, en lugar de expresarlo mediante la cantidad total por volumen total de gentamicina. Ello puede llevar fácilmente a confundir la concentración con la cantidad total de gentamicina que tiene el vial.
Además, como la concentración del vial de 240 mg (80 mg/mL) se corresponde con la cantidad total de la presentación de 80 mg, se puede llegar también a administrar este vial entero como si se tratara de la dosis de 80 mg. Este mismo problema puede surgir al confundir la concentración del vial de 80 mg (40 mg/mL) con la cantidad total del vial de 40 mg.
La AEMPS acaba de difundir una nota informativa y está trabajando con el laboratorio titular, para que indique la cantidad total de gentamicina en el envase y en los viales de todas las presentaciones.
Mientras tanto, desde el ISMP-España se recomienda a los centros que establezcan las medidas oportunas para evitar errores. En concreto, se aconseja que informen de este cambio a todos los profesionales sanitarios y que reetiqueten los envases indicando la cantidad total por volumen total de gentamicina.

GentaGobens® 80 mg/2 mL antes (superior) y ahora (inferior) |

GentaGobens® 240 mg/3 mL antes (superior) y ahora (inferior) |












